Difference between revisions of "AY Honors/Chemistry/Answer Key/es"
(Created page with "Una clase de sustancias que no se pueden separar en sustancias más simples por medios químicos.") |
|||
| (68 intermediate revisions by 2 users not shown) | |||
| Line 1: | Line 1: | ||
| − | + | {{HonorSubpage}} | |
| − | |||
| − | {{ | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
<section begin="Body" /> | <section begin="Body" /> | ||
{{ansreq|page={{#titleparts:{{PAGENAME}}|2|1}}|num=1}} | {{ansreq|page={{#titleparts:{{PAGENAME}}|2|1}}|num=1}} | ||
| Line 28: | Line 15: | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | + | Una sustancia uniforme compuesta de dos o más elementos. | |
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 35: | Line 22: | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | + | Cada elemento está representado mediante una abreviatura de uno o dos caracteres que representan el nombre del elemento. La primera letra está siempre en mayúscula y la segunda, si existe, está siempre en minúscula. | |
| − | :H | + | :H representa hidrógeno |
| − | :He | + | :He representa el helio |
| − | :Li | + | :Li representa litio |
| − | :C | + | :C representa carbono |
| − | + | Algunos de los símbolos no representan el nombre moderno, sino un nombre original. | |
| − | :Ag | + | :Ag representa argentum (''latín'') o la plata |
| − | :Au | + | :Au representa aurum (''latín'') o el oro |
| − | :W | + | :W representa wolframio (''alemán'') o tungsteno |
| − | + | Hay 94 elementos que se encuentran de forma natural en la tierra, y hay otros 17 que se han creado en los aceleradores atómicos que tienen vidas medias muy cortas. Otros 7 elementos han sido reportados pero todavía están en la etapa de confirmar/nombrar. Todos estos elementos están organizados usando una «tabla periódica de los elementos» que fue creado por [[esw:Dmitri_Mendel%C3%A9yev|Dmitri Mendeléyev]]. | |
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 53: | Line 40: | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | + | Una mezcla de dos o más sustancias que no reaccionan químicamente. Si disuelve el azúcar, la sal u otra sustancia en el agua, está haciendo una solución. | |
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 60: | Line 47: | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | + | Los átomos son los bloques básicos de la materia. Los átomos varían en tamaño desde 5Å a 24Å (Å es el símbolo de una unidad de medida conocida como un angstrom. Un pelo rubio es de entre 170.000 y 500.000Å de diámetro y un pelo negro está entre 560.000 y 1.810.000Å de diámetro). | |
| − | + | Los átomos son mayormente espacio vacío, pero debido a que los electrones se mueven tan rápidamente, la materia que se toca puede sentirse muy sólido. El hidrógeno es el átomo más simple; está hecho de un protón y un electrón. Un modelo clásico de un átomo es pensar en el electrón orbitando el protón central. Si se crea un modelo de este átomo con el protón del tamaño de una bola de baloncesto, entonces el electrón sería del tamaño de un grano de sal y orbitaría a una distancia de 12 kilómetros. | |
| − | + | No se puede ver directamente a los átomos con un microscopio regular. La luz tiene una longitud de onda de entre 4.000Å y 7.000Å que es aproximadamente 1.000 veces el diámetro de un átomo. Debido a que la longitud de onda de la luz es tan largo, casi no tiene interacción con el átomo. El centro de un átomo puede ser «visto» y las posiciones de la nube de electrones alrededor de un átomo se puede determinar mediante el uso de una placa de rayos X, un haz (de neutrones o de electrones; que tienen longitudes de onda mucho más pequeñas que la luz) en técnicas tales como | |
| − | [[ | + | [[esw:Cristalografía_de_rayos_X|cristalografía de rayos X]], [[esw:Difracción_de_neutrones|difracción de neutrones]] o cristalografía de electrones. O un [[esw:Microscopio_de_efecto_túnel|microscopio de efecto túnel]] se puede usar. |
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 72: | Line 59: | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | + | Dos o más átomos que se han unido entre sí. | |
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 79: | Line 66: | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
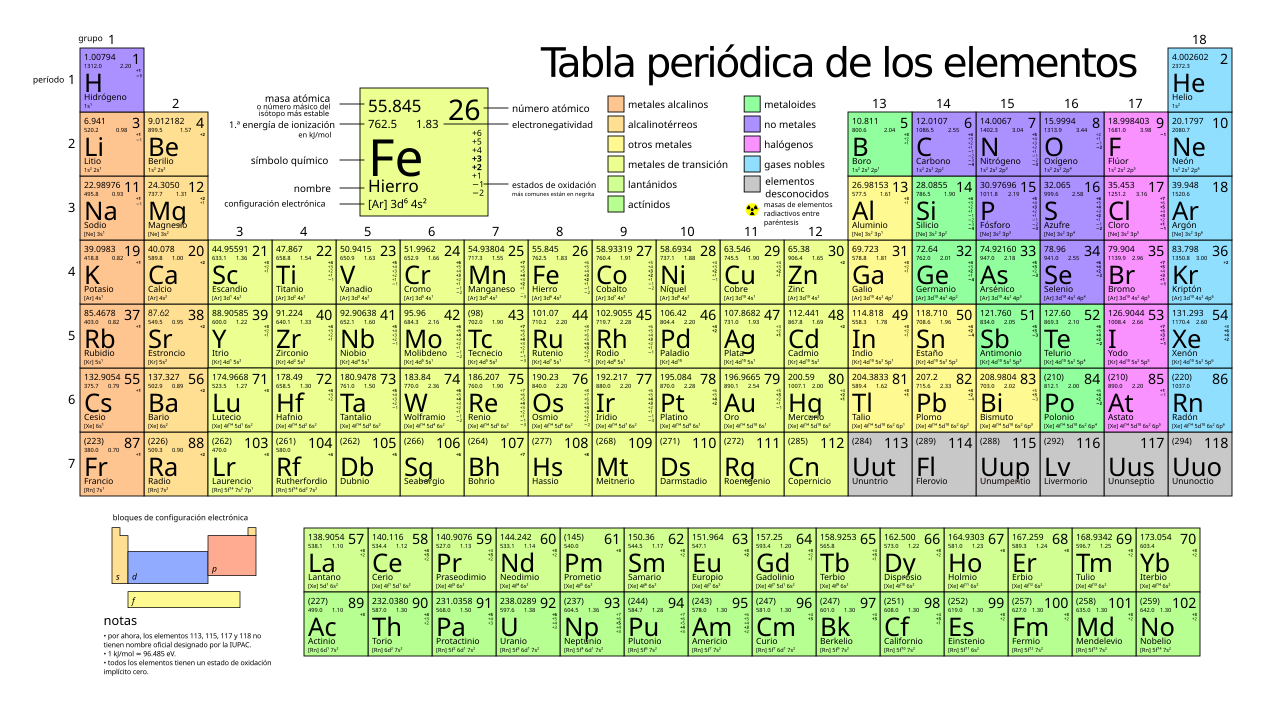
| − | + | La tabla periódica de los elementos químicos es un método tabular de mostrar los elementos químicos. La tabla muestra tendencias («periódicas») que se repiten en las propiedades de los elementos. | |
| − | {{Small Periodic table}} | + | {{Small Periodic table/es}} |
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 87: | Line 74: | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | + | Usualmente se usa la palabra de combustión para describir el proceso químico de un combustible que combina rápidamente con un oxidante (generalmente oxígeno), es decir, quema. Este proceso usualmente se asocia con las llamas, la luz, el calor y el humo. | |
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 94: | Line 81: | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | + | La palabra ácido proviene de la palabra latina ''acidus'' que significa agrio. En los primeros días de la química, era una práctica común para saboreaer u oler las cosas y registrar la sensación. Muchas cosas que son ácidos son agrias. El jugo de limón es amargo debido al ácido cítrico que tiene. | |
| − | + | Debido a que muchas sustancias pueden ser tóxicas, esto probablemente mató a un número de químicom, incluyendo el científico famoso Humphry Davy, el hombre que tuvo la teoría que explica la naturaleza de un ácido. | |
| − | Davy | + | La hipótesis de Davy fue que los ácidos eran sustancias que contenían hidrógeno reemplazable. Este hidrógeno podría ser reemplazado por los metales y esta reacción dejaría sal. |
| − | :2HCl + Zn → ZnCl<sub>2</sub> + H<sub>2</sub> <br> | + | :2HCl + Zn → ZnCl<sub>2</sub> + H<sub>2</sub> <br /> |
:Fe + H<sub>2</sub>SO<sub>4</sub> → H<sub>2</sub> + FeSO<sub>4</sub> | :Fe + H<sub>2</sub>SO<sub>4</sub> → H<sub>2</sub> + FeSO<sub>4</sub> | ||
| Line 108: | Line 95: | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | + | Una sal es un término para la forma sólida de un compuesto iónico, tales como cloruro sódico (Na<sup>+</sup>Cl<sup>-</sup>) o hidróxido de potasio (K<sup>+</sup>(OH)<sup>-</sup>). | |
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 115: | Line 102: | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | + | Una partícula cargada positivamente que es una parte del núcleo de un átomo. Los protones tienen una masa de <math>1,67 \times 10 ^{-27}</math> kg. Un centímetro cúbico de agua contiene <math> 6,02 \times 10 ^{24}</math> protones que forman el núcleo de los átomos de hidrógeno y oxígeno. El hidrógeno tiene un protón en su centro y el oxígeno tiene 8 protones. | |
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 122: | Line 109: | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | + | Una partícula cargada neutralmente que es una parte del núcleo de un átomo. Los neutrones tienen una masa de <math> 1,67 \times 10 {- 27} </math> kg. Cuando se fija en el agua se encuentra con que se compone de hidrógeno y oxígeno. El hidrógeno no tiene neutrones pero cada átomo de oxígeno tiene 8 neutrones. | |
| − | + | Los neutrones se mantienen unidos por lo que se llama la «fuerza débil». Los neutrones libres se descomponen con una vida media de alrededor de 10,3 minutos en un protón, electrón y un neutrino electrónico. En el núcleo de un átomo, los neutrones pueden ser bastante estables porque hay otra fuerza conocida como la «fuerza fuerte». | |
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 131: | Line 118: | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | + | Una partícula con carga negativa con una masa de <math>9,11 \times 10^{-31}</math> kg. Los electrones forman una nube alrededor del núcleo cargado positivamente de un átomo. | |
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 137: | Line 124: | ||
{{ansreq|page={{#titleparts:{{PAGENAME}}|2|1}}|num=1n}} <!--T:36--> | {{ansreq|page={{#titleparts:{{PAGENAME}}|2|1}}|num=1n}} <!--T:36--> | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | + | La destilación, que es calentar el líquido hasta la ebullición y la recogida de los vapores condensados, es una técnica útil para separar los componentes en base a diferentes puntos de ebullición. La destilación separa dos líquidos volátiles donde el componente más volátil es más puro. Cuanto más separados son las temperaturas de ebullición, lo más probable que la destilación será exitoso. Cuanto más bajo sea el punto de ebullición, lo más volátil será el compuesto y por lo tanto más rápido se vaporizará. El éxito también depende de las interacciones entre las partículas, ya que dos líquidos diferentes que se disuelven uno en el otro es probable que formen '''azeótropos'''. Si esto ocurre, las fases de líquido y gas tendrán la misma composición y por lo tanto la ebullición no causará una separación adicional. | |
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 143: | Line 130: | ||
{{ansreq|page={{#titleparts:{{PAGENAME}}|2|1}}|num=1o}} <!--T:37--> | {{ansreq|page={{#titleparts:{{PAGENAME}}|2|1}}|num=1o}} <!--T:37--> | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | [[File: | + | [[File:Destilacion fraccionada 2.png|thumb|350 px|Destilación fraccionada]] |
| − | + | La destilación fraccionada es una técnica en la que varias destilaciones se producen en la misma columna, mediada por alguna clase de medio poroso. Permite la separación de sustancias con puntos de ebullición más iguales que la destilación simple, y también hace que la destilación de las mismas soluciones sean más eficientes. La destilación fraccionada obtiene una mejor separación con respecto a la destilación simple debido a algunos factores. Una es que la columna de destilación está generalmente llena de cobre, alambre o cuentas vidrio. Esto aumenta el área de la superficie, lo que permite la vaporización y condensación continua y eficiente mediante el intercambio del calor entre el vapor y lo condensado. | |
{{clear}} | {{clear}} | ||
| Line 152: | Line 139: | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | + | La filtración es una técnica en la cual un precipitado sólido (o residuos sólidos) se separa de un líquido. La mezcla se coloca sobre un papel de filtro, que permite que el líquido pase, dejando lo sólido atrapado. Típicamente, el líquido se pone a una temperatura de tal manera que hay poco sólido disuelto en el líquido, de modo que la separación es más eficaz. Esta filtración puede hacerse utilizando sólo la gravedad, o la succión se puede utilizar. | |
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 159: | Line 146: | ||
{{ansreq|page={{#titleparts:{{PAGENAME}}|2|1}}|num=2}} | {{ansreq|page={{#titleparts:{{PAGENAME}}|2|1}}|num=2}} | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | <!-- 2. | + | <!-- 2. Qué gases extinguen la vida y cómo lo hacen? Explicar el principio de uno de las clases de producto químico del extintor de incendios. --> |
| − | + | Al extremo, casi cualquier gas puede matar a una persona. Incluso el oxígeno puro puede matar porque el cuerpo no puede tratar eficazmente el oxígeno puro. Los gases pueden matar por medio de: | |
| − | :1 | + | :1: Asfixia - El gas desplaza el oxígeno y el cuerpo muere con la falta de oxígeno. Algunos de los gases axfixiantes más peligrosos son compuestos de oxidación como <math>CO_2</math> o CO. |
| − | :2 | + | :2: Veneno - Hay gases como el gas cianuro de hidrógeno HCN que son bastante venenosos. El cianuro se une a los átomos de hierro en la enzima conocida como la citocromo c oxidasa o complejo IV, y por lo tanto bloquea la producción del ATP. El ATP, o trifosfato de adenosina, es la moneda de energía universal de todos los organismos vivos. |
| − | :3 | + | :3: Explosión - Muchos de los gases son muy inflamables y pueden explotar bastante destructivamente. La mayor parte de los hidrocarburos ligeros en las minas se pueden explotar con sólo una pequeña chispa. |
| − | + | El fuego, como la vida, requiere de oxígeno, por lo que un método común utilizado en los extintores de incendios es el uso de un gas o líquido que no dejará el oxígeno llegar al combustible. | |
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 175: | Line 162: | ||
{{ansreq|page={{#titleparts:{{PAGENAME}}|2|1}}|num=3}} | {{ansreq|page={{#titleparts:{{PAGENAME}}|2|1}}|num=3}} | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | <!-- 3. | + | <!-- 3. Nombrar dos fuentes comunes de monóxido de carbono. ¿Por qué es peligroso? --> |
| − | + | El escape de un automóvil, antes del convertidor catalítico, contiene grandes cantidades de CO (monóxido de carbono). Si el sistema de escape está dañado antes de este punto, existe el peligro de respirar el gas sofocante. El catalizador convierte la mayor parte del CO a <math>CO_2</math> (dióxido de carbono). Todavía puede haber suficiente CO en el escape de los automóviles para ser fatal, pero como la mayoría es ahora <math>CO_2</math>, que tiene un olor o al menos la sensación, hay menos posibilidades de asfixia accidental (el <math>CO_2</math> también puede ser fatal pero es muy cáustico, creando una sensación de ardor en la nariz y los pulmones. Si ha respirado las burbujas de una gaseosa, ha olido el <math>CO_2</math>). | |
| − | + | Otra fuente común de CO es de gas natural o estufas de propano, calentadores, calentadores de agua o secadoras de ropa. Si estos aparatos se dañan, pueden ser muy peligrosos. Es una buena idea tener un detector de CO cerca de un horno calentador viejo de agua para dar una alerta a tiempo. | |
| − | + | El oxígeno es transportado a las células de los pulmones por los glóbulos rojos y el CO<sub>2</sub> se lleva de nuevo a los pulmones para ser exhalado. Los glóbulos rojos tienen un espacio trideimensional que se le cabe al oxígeno y CO<sub>2</sub> pero permite que sean expulsados cuando llegan a su destino. El CO también puede caber en el espacio, pero no se va, entonces un glóbulo rojo cargado de CO ya no está disponible para hacer su trabajo. Si suficientes glóbulos rojos se ven afectados, las células del cuerpo no pueden obtener el oxígeno que necesitan y los residuos de CO<sub>2</sub> se acumula, llevando el organismo a la muerte. | |
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 187: | Line 174: | ||
{{ansreq|page={{#titleparts:{{PAGENAME}}|2|1}}|num=4}} | {{ansreq|page={{#titleparts:{{PAGENAME}}|2|1}}|num=4}} | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | <!-- 4. | + | <!-- 4. ¿Cuáles son los estados de la materia? --> |
| − | ;[[ | + | ;[[esw:Sólido|Sólido]] |
| − | : | + | :Los átomos están en una estructura bastante rígida que a nivel macroscópico se sienteN duroS o sólidoS. Los átomos pueden ser organizados en una estructura cristalina muy rígida, pero todavía hay vibración dentro de la estructura. |
| − | ;[[ | + | ;[[esw:Líquido|Líquido]] |
| − | : | + | :Los átomos son libres de moverse, pero no se separan como un gas. Los líquidos pueden fluir y generalmente no se sienten sólidos o rígidos. Los líquidos no son compresibles. Cuando el helio se enfría cerca del cero absoluto, se comporta extrañamente, convirtiéndose en un superfluido. Es peligroso de manejar debido a su temperatura. |
| − | ;[[ | + | ;[[esw:Gas|Gas]] |
| − | : | + | :Las moléculas de un gas son completamente libres para moverse y a temperatura ambiente se mueven decenas de metros antes de llegar a otra molécula. Un gas es ventilado. No sabrá necesariamente que está allí a menos que se mueva a través del gas y sienta el viento. |
| − | ;[[ | + | ;[[esw:Plasma_(estado_de_la_materia)|Plasma]] |
| − | : | + | :Las moléculas de un plasma se ionizan, lo que hace que se repelen entre sí, entonces un plasma puede aparecer a fluir casi como un líquido y brilla mientras algunas de las moléculas cambian de estado de ionización. |
| − | + | Los estados de la materia se definen en gran medida basado en el nivel de interacción entre las moléculas y los átomos que forman la materia. Esta interacción es dependiente de la temperatura (y la presión) y hay puntos bien definidos de congelación (líquido a sólido), puntos de fusión (sólido a líquido), puntos de ebullición (líquido a gas) y puntos de condensación (gas a líquido) para cada elemento o molécula a una presión de aire particular (es decir, la presión normal del nivel del mar). | |
| − | '' | + | ''Esto es por qué el agua hierve a una temperatura más baja en una montaña que tiene menos presión de aire que a nivel del mar. Esto puede afectar la eficiencia de la esterilización de agua hirviendo y se necesita un tiempo más largo.'' |
| − | ''CO<sub>2</sub> | + | ''El CO<sub>2</sub> es un gas raro porque en su forma sólida que no se derrite sino que va directamente a un gas (sublimar). Esta es la razón porque el CO<sub>2</sub> congelado se conoce como hielo seco, ya que no pasa por una forma líquida y no está «húmedo».'' |
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 209: | Line 196: | ||
{{ansreq|page={{#titleparts:{{PAGENAME}}|2|1}}|num=5}} | {{ansreq|page={{#titleparts:{{PAGENAME}}|2|1}}|num=5}} | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | <!-- 5. | + | <!-- 5. Hacer cinco de las siguientes actividades y explicar la acción química que se lleva a cabo: --> |
| − | |||
| − | |||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 217: | Line 202: | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | ; | + | ;Materiales: |
| − | * | + | * Cubos de azúcar |
| − | * | + | * Ceniza de una chimenea o fogata |
| − | * | + | * Fósforos o encendedor |
| − | * | + | * Aluminio |
| − | * | + | * Pedazo de madera o trébede para actuar como insulador |
| − | ; | + | ;Método |
| − | * | + | * Ponga un pedazo de aluminio sobre el trébede o un pedazo de madera. |
| − | * | + | * Ponga el cubo de azúcar cerca del centro del aluminio. |
| − | * | + | * Tome otro cubo de azúcar y cúbralo con ceniza. |
| − | * | + | * Ponga el cubo de azúcar al lado del primer cubo, pero no deje que toquen. |
| − | * | + | * Trate de encender cada cubo de azúcar. Debe ser más fácil encender el cubo de azúcar que tiene ceniza. |
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 235: | Line 220: | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | ; | + | ;Materiales |
| − | * | + | * Hielo |
| − | * | + | * Sal |
| − | * | + | * Agua |
| − | * | + | * Vaso de vidrio |
| − | * | + | * Cordón de 10 cm de largo |
| − | ; | + | ;Método |
| − | * | + | * Ponga el cubo de hielo en el vaso |
| − | * | + | * Amarre una vuelta en el cordón y póngalo sobre el cubo |
| − | * | + | * Ponga un poquito de sal en la vuelta y el cubo |
| − | * | + | * Espere un rato y suba el cordón |
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 252: | Line 237: | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | ; | + | ;Materiales: |
| − | * | + | * 20 ml de jabón en polvo(ejemplo: Roma) |
| − | * 60 ml | + | * 60 ml de agua caliente |
| − | * 15 ml | + | * 15 ml de trementina |
| − | * | + | * Cuenco pequeño |
| − | * | + | * Pincel |
| − | * | + | * Periódico o revista vieja |
| − | |||
| − | ; | + | ;Método: |
| − | * | + | * Disuelva el polvo de jabón en agua caliente y luego añade la trementina. |
| − | * | + | * Para utilizar, moje un pincel en la tinta y pinte sobre la imagen para ser transferida, espere unos diez segundos y luego coloque una hoja de papel sobre la imagen y frote la parte posterior con una cuchara. La imagen se transferirá al papel. |
| − | + | La tinta se solidificará en el contenedor después de un rato. Para revertir esto, simplemente ponga la botella en un recipiente con agua tibia hasta que se derrita y luego agite. | |
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 274: | Line 258: | ||
[[Image:Kaarsvlam-kl.jpg|thumb|left|200px]] | [[Image:Kaarsvlam-kl.jpg|thumb|left|200px]] | ||
| − | ;1 | + | ;1 - Zona azul: El área azul es la base de la llama. En esta área, la '''[[esw:Pirólisis|pirólisis]]''' toma lugar (donde la cera de la vela ''cambia de estado'' en un gas combustible). Además, parte de la ''combustión'' toma lugar aquí. La temperatura en esta superficie es aproximadamente 1200-1400º C. |
| − | ;2 | + | ;2 - Zona oscura: El área oscura en el medio de la llama justo por encima de la punta. Este núcleo oscuro de la llama es aproximadamente 800-1000º C. Dentro de estas regiones más azules, el hidrógeno está siendo separada del combustible y quemada para formar vapor de agua. |
| − | ;3 | + | ;3 - Zona luminosa: La zona luminosa amarilla está por encima de la zona oscura. Esta parte de la llama más brillante y más amarilla es el carbono restante que se oxida para formar dióxido de carbono. Las partículas incandescentes de hollín hace el brillo de color naranja y amarillo. Esta área es de aproximadamente 1200º C. |
| − | ;4 | + | ;4 - Manto de la llama: esto está en el borde exterior de la llama y es incoloro o una muy tenue azul, y es la parte más caliente de la llama en una vela. Es aproximadamente 1400º C. |
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 287: | Line 271: | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | ; | + | ;Materiales: |
| − | * | + | * Cubo de azúcar |
| − | * | + | * Detergente de lavar trastes |
| − | * 2 | + | * 2 cuencos pequeños |
| − | * 12 | + | * 12 palillos (o fósforos de madera) |
| − | * | + | * Agua |
| − | ; | + | ;Método: |
| − | * | + | * Llene los cuencos con agua. |
| − | * | + | * Ponga la mitad de los palillos en cada cuenco. |
| − | * | + | * Ponga el cubo de azúcar en un cuenco. Los palillos se acercarán al cubo. |
| − | * | + | * Ponga una gota de detergente en el otro cuenco. Los palillos se alejarán de la gota. |
| − | + | El azúcar absorbe el agua y cuando lo hace se crea una pequeña corriente que atrae a los palillos. El detergente, por otro lado, rompe la tensión superficial del agua e inmediatamente se extiende sobre la superficie. Mientras que se mueve por la superficie, también crea una corriente que lleva los palillos con ella. | |
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 306: | Line 290: | ||
{{ansreq|page={{#titleparts:{{PAGENAME}}|2|1}}|num=5f}} <!--T:73--> | {{ansreq|page={{#titleparts:{{PAGENAME}}|2|1}}|num=5f}} <!--T:73--> | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | ; | + | ;Materiales: |
| − | * | + | * Huevo (no codido) |
| − | * | + | * Un litro de agua |
| − | * | + | * 120 ml de sal |
| − | * 2 | + | * 2 cuencos |
| − | ; | + | ;Métodos: |
| − | * | + | * Agregue la sal y medio litro de agua a un cuenco y mezcle hasta que se desuelve la sal. |
| − | * | + | * Agregue el otro medio litro de agua en el otro cuenco pero no le ponga la sal todavía. |
| − | * | + | * Ponga el huevo en el agua con sal. Debe flotar. |
| − | * | + | * Mueva el huevo al agua sin sal. Debe hundirse. |
| − | + | El agua salada es más densa que el agua dulce, que significa que un volumen de agua salada pesa más que un volumen igual de agua dulce. La densidad de un huevo está entre la densidad del agua salada y agua dulce. Un elemento flotará si es menos denso que el líquido en el que se coloca. El huevo es más densa que el agua dulce y por eso se hunde. Pero, debido a que el huevo es menos denso que el agua salada, flota. NOTA: Si no pasa nada, obtenga dos huevos y coloque uno en el agua dulce y el otro en el agua salada. El huevo de agua dulce debe expandirse y el huevo de agua salada debe contraerse debido a la ósmosis. | |
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 324: | Line 308: | ||
{{ansreq|page={{#titleparts:{{PAGENAME}}|2|1}}|num=5g}} <!--T:76--> | {{ansreq|page={{#titleparts:{{PAGENAME}}|2|1}}|num=5g}} <!--T:76--> | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | ; | + | ;Materiales |
| − | * | + | * Lana de acero |
| − | * | + | * Lápiz |
| − | * | + | * Gomita (bandita elástica) |
| − | * | + | * Vaso de vidrio |
| − | * | + | * Cuenco |
| − | * | + | * Agua |
| − | ; | + | ;Método |
| − | + | Utilice la gomita para sujetar la lana de acero al borrador del lápiz. El lápiz debe ser lo suficientemente corto para que puede caber dentro del vaso sin que sobresalga de la parte superior. Llenar hasta la mitad el vaso con agua y coloque el lápiz en el vaso con el montón de lana de acero en la parte inferior. Coloque un cuenco boca abajo sobre la parte superior del vaso y gire con cuidado el vaso y el cuenco de manera que el vaso está boca abajo y el cuenco está boca arriba. Añade un poco de agua al cuenco y marque el nivel de agua en el lado del vaso. Coloque el aparato en algún lugar donde no se verá interrumpido. Después de unos días, revise la lana de acero - debe estar oxidada. | |
| − | + | Mientras la lana de acero se oxida, utiliza el oxígeno atrapado en el vaso. Esto reduce el volumen de aire adentro del vaso y la presión atmosférica fuera del vaso compensará por medio de empujar hacia abajo contra el agua dentro del cuenco. Esto entonces impulsará el agua dentro del vaso más alto. Compare el nivel actual del agua al nivel marcado en el comienzo del experimento. | |
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 341: | Line 325: | ||
{{ansreq|page={{#titleparts:{{PAGENAME}}|2|1}}|num=5h}} <!--T:79--> | {{ansreq|page={{#titleparts:{{PAGENAME}}|2|1}}|num=5h}} <!--T:79--> | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | * ''' | + | * '''Sal''': La sal común de mesa es ''Cloruro de sodio'' y es un amarillo anaranjado |
| − | * ''' | + | * '''Sulfato de cobre''': Verde azul |
<gallery> | <gallery> | ||
| − | Image:Flametest--Cu.swn.jpg| | + | Image:Flametest--Cu.swn.jpg|Sulfato de cobre |
| − | Image:Flametest-Co-Cu.swn.jpg| | + | Image:Flametest-Co-Cu.swn.jpg|Sulfato de cobre (por medio de vidrio de cobre) |
| − | Image:Flametest--Na.swn.jpg| | + | Image:Flametest--Na.swn.jpg|Cloruro de sodio |
</gallery> | </gallery> | ||
| − | * | + | * Ácido bórico: Verde brillante |
| − | ''' | + | '''Más colores/llamas''' (porque son muy coloridos) |
<gallery> | <gallery> | ||
| − | Image:Flametest--.swn.jpg| | + | Image:Flametest--.swn.jpg|Llama de gas |
| − | Image:FlammenfärbungSb.png| | + | Image:FlammenfärbungSb.png|Antimonio, Sb |
| − | Image:FlammenfärbungAs.jpg| | + | Image:FlammenfärbungAs.jpg|Arsénico, As |
| − | Image:FlammenfärbungB.png| | + | Image:FlammenfärbungB.png|Boro, B |
| − | Image:FlammenfärbungCa.png| | + | Image:FlammenfärbungCa.png|Calcio, Ca |
| − | Image:Flametest--Cu.swn.jpg| | + | Image:Flametest--Cu.swn.jpg|Cobre, Cu |
| − | Image:FlammenfärbungPb.png| | + | Image:FlammenfärbungPb.png|Plomo, Pb |
| − | Image:FlammenfärbungLi.png| | + | Image:FlammenfärbungLi.png|Litio, Li |
| − | Image:FlammenfärbungK.png| | + | Image:FlammenfärbungK.png|Potasio, K |
| − | Image:Flametest--Na.swn.jpg| | + | Image:Flametest--Na.swn.jpg|Sodio, Na |
| − | Image:FlammenfärbungSr.png| | + | Image:FlammenfärbungSr.png|Estroncio, Sr |
</gallery> | </gallery> | ||
| Line 371: | Line 355: | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | ; | + | ;Materiales |
| − | * | + | * Agua |
| − | * | + | * Vinagre, jugo de limón, azúcar, cebolla |
| − | * | + | * Vasos pequeños |
| − | * | + | * Vela o llama de estufa |
| − | * | + | * Papel |
| − | |||
| − | ; | + | ;Métodos |
| − | + | Puede mezclar el vinagre, jugo de limón, azúcar o jugo de cebolla con agua para crear una tinta invisible. Para hacer visible la tinta, manténgala con cuidado sobre una fuente de calor. La «tinta» se mostrará y llegará a ser visible. Trate de mezclar una pequeña cantidad de tinta que utiliza cada clase de ingrediente para ver cuál funciona mejor. | |
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 386: | Line 369: | ||
{{ansreq|page={{#titleparts:{{PAGENAME}}|2|1}}|num=5j}} <!--T:84--> | {{ansreq|page={{#titleparts:{{PAGENAME}}|2|1}}|num=5j}} <!--T:84--> | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | ; | + | ;Materiales |
| − | * | + | * Tubos de ensayo/pinzas |
| − | * | + | * Soda de lavado/sosa/detergente |
| − | * | + | * Vela o llama de estufa |
| − | ; | + | ;Métodos |
| − | + | Ponga una pequeña cantidad de la sosa en el tubo de ensayo. Sostenga el tubo de ensayo con las pinzas sobre la llama. Verá un efecto como tornado en el interior del tubo de ensayo ya que el agua hace su «escape». ¡Es muy divertido para que todos vean! | |
<noinclude></noinclude> | <noinclude></noinclude> | ||
| Line 398: | Line 381: | ||
{{CloseReq}} <!-- 5 --> | {{CloseReq}} <!-- 5 --> | ||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | == | + | ==Nota histórica== |
| − | + | Esta especialidad fue clasificada previamente como una especialidad de Naturaleza con un fondo blanco. | |
| − | == | + | ==Referencias== |
| − | |||
<noinclude></noinclude> | <noinclude></noinclude> | ||
| − | + | {{CloseHonorPage}} | |
Latest revision as of 00:25, 26 July 2022
1
1a
Una clase de sustancias que no se pueden separar en sustancias más simples por medios químicos.
1b
Una sustancia uniforme compuesta de dos o más elementos.
1c
Cada elemento está representado mediante una abreviatura de uno o dos caracteres que representan el nombre del elemento. La primera letra está siempre en mayúscula y la segunda, si existe, está siempre en minúscula.
- H representa hidrógeno
- He representa el helio
- Li representa litio
- C representa carbono
Algunos de los símbolos no representan el nombre moderno, sino un nombre original.
- Ag representa argentum (latín) o la plata
- Au representa aurum (latín) o el oro
- W representa wolframio (alemán) o tungsteno
Hay 94 elementos que se encuentran de forma natural en la tierra, y hay otros 17 que se han creado en los aceleradores atómicos que tienen vidas medias muy cortas. Otros 7 elementos han sido reportados pero todavía están en la etapa de confirmar/nombrar. Todos estos elementos están organizados usando una «tabla periódica de los elementos» que fue creado por Dmitri Mendeléyev.
1d
Una mezcla de dos o más sustancias que no reaccionan químicamente. Si disuelve el azúcar, la sal u otra sustancia en el agua, está haciendo una solución.
1e
Los átomos son los bloques básicos de la materia. Los átomos varían en tamaño desde 5Å a 24Å (Å es el símbolo de una unidad de medida conocida como un angstrom. Un pelo rubio es de entre 170.000 y 500.000Å de diámetro y un pelo negro está entre 560.000 y 1.810.000Å de diámetro).
Los átomos son mayormente espacio vacío, pero debido a que los electrones se mueven tan rápidamente, la materia que se toca puede sentirse muy sólido. El hidrógeno es el átomo más simple; está hecho de un protón y un electrón. Un modelo clásico de un átomo es pensar en el electrón orbitando el protón central. Si se crea un modelo de este átomo con el protón del tamaño de una bola de baloncesto, entonces el electrón sería del tamaño de un grano de sal y orbitaría a una distancia de 12 kilómetros.
No se puede ver directamente a los átomos con un microscopio regular. La luz tiene una longitud de onda de entre 4.000Å y 7.000Å que es aproximadamente 1.000 veces el diámetro de un átomo. Debido a que la longitud de onda de la luz es tan largo, casi no tiene interacción con el átomo. El centro de un átomo puede ser «visto» y las posiciones de la nube de electrones alrededor de un átomo se puede determinar mediante el uso de una placa de rayos X, un haz (de neutrones o de electrones; que tienen longitudes de onda mucho más pequeñas que la luz) en técnicas tales como cristalografía de rayos X, difracción de neutrones o cristalografía de electrones. O un microscopio de efecto túnel se puede usar.
1f
Dos o más átomos que se han unido entre sí.
1g
La tabla periódica de los elementos químicos es un método tabular de mostrar los elementos químicos. La tabla muestra tendencias («periódicas») que se repiten en las propiedades de los elementos.
1h
Usualmente se usa la palabra de combustión para describir el proceso químico de un combustible que combina rápidamente con un oxidante (generalmente oxígeno), es decir, quema. Este proceso usualmente se asocia con las llamas, la luz, el calor y el humo.
1i
La palabra ácido proviene de la palabra latina acidus que significa agrio. En los primeros días de la química, era una práctica común para saboreaer u oler las cosas y registrar la sensación. Muchas cosas que son ácidos son agrias. El jugo de limón es amargo debido al ácido cítrico que tiene.
Debido a que muchas sustancias pueden ser tóxicas, esto probablemente mató a un número de químicom, incluyendo el científico famoso Humphry Davy, el hombre que tuvo la teoría que explica la naturaleza de un ácido.
La hipótesis de Davy fue que los ácidos eran sustancias que contenían hidrógeno reemplazable. Este hidrógeno podría ser reemplazado por los metales y esta reacción dejaría sal.
- 2HCl + Zn → ZnCl2 + H2
- Fe + H2SO4 → H2 + FeSO4
1j
Una sal es un término para la forma sólida de un compuesto iónico, tales como cloruro sódico (Na+Cl-) o hidróxido de potasio (K+(OH)-).
1k
Una partícula cargada positivamente que es una parte del núcleo de un átomo. Los protones tienen una masa de [math]\displaystyle{ 1,67 \times 10 ^{-27} }[/math] kg. Un centímetro cúbico de agua contiene [math]\displaystyle{ 6,02 \times 10 ^{24} }[/math] protones que forman el núcleo de los átomos de hidrógeno y oxígeno. El hidrógeno tiene un protón en su centro y el oxígeno tiene 8 protones.
1l
Una partícula cargada neutralmente que es una parte del núcleo de un átomo. Los neutrones tienen una masa de [math]\displaystyle{ 1,67 \times 10 {- 27} }[/math] kg. Cuando se fija en el agua se encuentra con que se compone de hidrógeno y oxígeno. El hidrógeno no tiene neutrones pero cada átomo de oxígeno tiene 8 neutrones.
Los neutrones se mantienen unidos por lo que se llama la «fuerza débil». Los neutrones libres se descomponen con una vida media de alrededor de 10,3 minutos en un protón, electrón y un neutrino electrónico. En el núcleo de un átomo, los neutrones pueden ser bastante estables porque hay otra fuerza conocida como la «fuerza fuerte».
1m
Una partícula con carga negativa con una masa de [math]\displaystyle{ 9,11 \times 10^{-31} }[/math] kg. Los electrones forman una nube alrededor del núcleo cargado positivamente de un átomo.
1n
La destilación, que es calentar el líquido hasta la ebullición y la recogida de los vapores condensados, es una técnica útil para separar los componentes en base a diferentes puntos de ebullición. La destilación separa dos líquidos volátiles donde el componente más volátil es más puro. Cuanto más separados son las temperaturas de ebullición, lo más probable que la destilación será exitoso. Cuanto más bajo sea el punto de ebullición, lo más volátil será el compuesto y por lo tanto más rápido se vaporizará. El éxito también depende de las interacciones entre las partículas, ya que dos líquidos diferentes que se disuelven uno en el otro es probable que formen azeótropos. Si esto ocurre, las fases de líquido y gas tendrán la misma composición y por lo tanto la ebullición no causará una separación adicional.
1o
La destilación fraccionada es una técnica en la que varias destilaciones se producen en la misma columna, mediada por alguna clase de medio poroso. Permite la separación de sustancias con puntos de ebullición más iguales que la destilación simple, y también hace que la destilación de las mismas soluciones sean más eficientes. La destilación fraccionada obtiene una mejor separación con respecto a la destilación simple debido a algunos factores. Una es que la columna de destilación está generalmente llena de cobre, alambre o cuentas vidrio. Esto aumenta el área de la superficie, lo que permite la vaporización y condensación continua y eficiente mediante el intercambio del calor entre el vapor y lo condensado.
1p
La filtración es una técnica en la cual un precipitado sólido (o residuos sólidos) se separa de un líquido. La mezcla se coloca sobre un papel de filtro, que permite que el líquido pase, dejando lo sólido atrapado. Típicamente, el líquido se pone a una temperatura de tal manera que hay poco sólido disuelto en el líquido, de modo que la separación es más eficaz. Esta filtración puede hacerse utilizando sólo la gravedad, o la succión se puede utilizar.
2
Al extremo, casi cualquier gas puede matar a una persona. Incluso el oxígeno puro puede matar porque el cuerpo no puede tratar eficazmente el oxígeno puro. Los gases pueden matar por medio de:
- 1: Asfixia - El gas desplaza el oxígeno y el cuerpo muere con la falta de oxígeno. Algunos de los gases axfixiantes más peligrosos son compuestos de oxidación como [math]\displaystyle{ CO_2 }[/math] o CO.
- 2: Veneno - Hay gases como el gas cianuro de hidrógeno HCN que son bastante venenosos. El cianuro se une a los átomos de hierro en la enzima conocida como la citocromo c oxidasa o complejo IV, y por lo tanto bloquea la producción del ATP. El ATP, o trifosfato de adenosina, es la moneda de energía universal de todos los organismos vivos.
- 3: Explosión - Muchos de los gases son muy inflamables y pueden explotar bastante destructivamente. La mayor parte de los hidrocarburos ligeros en las minas se pueden explotar con sólo una pequeña chispa.
El fuego, como la vida, requiere de oxígeno, por lo que un método común utilizado en los extintores de incendios es el uso de un gas o líquido que no dejará el oxígeno llegar al combustible.
3
El escape de un automóvil, antes del convertidor catalítico, contiene grandes cantidades de CO (monóxido de carbono). Si el sistema de escape está dañado antes de este punto, existe el peligro de respirar el gas sofocante. El catalizador convierte la mayor parte del CO a [math]\displaystyle{ CO_2 }[/math] (dióxido de carbono). Todavía puede haber suficiente CO en el escape de los automóviles para ser fatal, pero como la mayoría es ahora [math]\displaystyle{ CO_2 }[/math], que tiene un olor o al menos la sensación, hay menos posibilidades de asfixia accidental (el [math]\displaystyle{ CO_2 }[/math] también puede ser fatal pero es muy cáustico, creando una sensación de ardor en la nariz y los pulmones. Si ha respirado las burbujas de una gaseosa, ha olido el [math]\displaystyle{ CO_2 }[/math]).
Otra fuente común de CO es de gas natural o estufas de propano, calentadores, calentadores de agua o secadoras de ropa. Si estos aparatos se dañan, pueden ser muy peligrosos. Es una buena idea tener un detector de CO cerca de un horno calentador viejo de agua para dar una alerta a tiempo.
El oxígeno es transportado a las células de los pulmones por los glóbulos rojos y el CO2 se lleva de nuevo a los pulmones para ser exhalado. Los glóbulos rojos tienen un espacio trideimensional que se le cabe al oxígeno y CO2 pero permite que sean expulsados cuando llegan a su destino. El CO también puede caber en el espacio, pero no se va, entonces un glóbulo rojo cargado de CO ya no está disponible para hacer su trabajo. Si suficientes glóbulos rojos se ven afectados, las células del cuerpo no pueden obtener el oxígeno que necesitan y los residuos de CO2 se acumula, llevando el organismo a la muerte.
4
- Sólido
- Los átomos están en una estructura bastante rígida que a nivel macroscópico se sienteN duroS o sólidoS. Los átomos pueden ser organizados en una estructura cristalina muy rígida, pero todavía hay vibración dentro de la estructura.
- Líquido
- Los átomos son libres de moverse, pero no se separan como un gas. Los líquidos pueden fluir y generalmente no se sienten sólidos o rígidos. Los líquidos no son compresibles. Cuando el helio se enfría cerca del cero absoluto, se comporta extrañamente, convirtiéndose en un superfluido. Es peligroso de manejar debido a su temperatura.
- Gas
- Las moléculas de un gas son completamente libres para moverse y a temperatura ambiente se mueven decenas de metros antes de llegar a otra molécula. Un gas es ventilado. No sabrá necesariamente que está allí a menos que se mueva a través del gas y sienta el viento.
- Plasma
- Las moléculas de un plasma se ionizan, lo que hace que se repelen entre sí, entonces un plasma puede aparecer a fluir casi como un líquido y brilla mientras algunas de las moléculas cambian de estado de ionización.
Los estados de la materia se definen en gran medida basado en el nivel de interacción entre las moléculas y los átomos que forman la materia. Esta interacción es dependiente de la temperatura (y la presión) y hay puntos bien definidos de congelación (líquido a sólido), puntos de fusión (sólido a líquido), puntos de ebullición (líquido a gas) y puntos de condensación (gas a líquido) para cada elemento o molécula a una presión de aire particular (es decir, la presión normal del nivel del mar).
Esto es por qué el agua hierve a una temperatura más baja en una montaña que tiene menos presión de aire que a nivel del mar. Esto puede afectar la eficiencia de la esterilización de agua hirviendo y se necesita un tiempo más largo.
El CO2 es un gas raro porque en su forma sólida que no se derrite sino que va directamente a un gas (sublimar). Esta es la razón porque el CO2 congelado se conoce como hielo seco, ya que no pasa por una forma líquida y no está «húmedo».
5
5a
- Materiales
- Cubos de azúcar
- Ceniza de una chimenea o fogata
- Fósforos o encendedor
- Aluminio
- Pedazo de madera o trébede para actuar como insulador
- Método
- Ponga un pedazo de aluminio sobre el trébede o un pedazo de madera.
- Ponga el cubo de azúcar cerca del centro del aluminio.
- Tome otro cubo de azúcar y cúbralo con ceniza.
- Ponga el cubo de azúcar al lado del primer cubo, pero no deje que toquen.
- Trate de encender cada cubo de azúcar. Debe ser más fácil encender el cubo de azúcar que tiene ceniza.
5b
- Materiales
- Hielo
- Sal
- Agua
- Vaso de vidrio
- Cordón de 10 cm de largo
- Método
- Ponga el cubo de hielo en el vaso
- Amarre una vuelta en el cordón y póngalo sobre el cubo
- Ponga un poquito de sal en la vuelta y el cubo
- Espere un rato y suba el cordón
5c
- Materiales
- 20 ml de jabón en polvo(ejemplo: Roma)
- 60 ml de agua caliente
- 15 ml de trementina
- Cuenco pequeño
- Pincel
- Periódico o revista vieja
- Método
- Disuelva el polvo de jabón en agua caliente y luego añade la trementina.
- Para utilizar, moje un pincel en la tinta y pinte sobre la imagen para ser transferida, espere unos diez segundos y luego coloque una hoja de papel sobre la imagen y frote la parte posterior con una cuchara. La imagen se transferirá al papel.
La tinta se solidificará en el contenedor después de un rato. Para revertir esto, simplemente ponga la botella en un recipiente con agua tibia hasta que se derrita y luego agite.
5d
- 1 - Zona azul
- El área azul es la base de la llama. En esta área, la pirólisis toma lugar (donde la cera de la vela cambia de estado en un gas combustible). Además, parte de la combustión toma lugar aquí. La temperatura en esta superficie es aproximadamente 1200-1400º C.
- 2 - Zona oscura
- El área oscura en el medio de la llama justo por encima de la punta. Este núcleo oscuro de la llama es aproximadamente 800-1000º C. Dentro de estas regiones más azules, el hidrógeno está siendo separada del combustible y quemada para formar vapor de agua.
- 3 - Zona luminosa
- La zona luminosa amarilla está por encima de la zona oscura. Esta parte de la llama más brillante y más amarilla es el carbono restante que se oxida para formar dióxido de carbono. Las partículas incandescentes de hollín hace el brillo de color naranja y amarillo. Esta área es de aproximadamente 1200º C.
- 4 - Manto de la llama
- esto está en el borde exterior de la llama y es incoloro o una muy tenue azul, y es la parte más caliente de la llama en una vela. Es aproximadamente 1400º C.
5e
- Materiales
- Cubo de azúcar
- Detergente de lavar trastes
- 2 cuencos pequeños
- 12 palillos (o fósforos de madera)
- Agua
- Método
- Llene los cuencos con agua.
- Ponga la mitad de los palillos en cada cuenco.
- Ponga el cubo de azúcar en un cuenco. Los palillos se acercarán al cubo.
- Ponga una gota de detergente en el otro cuenco. Los palillos se alejarán de la gota.
El azúcar absorbe el agua y cuando lo hace se crea una pequeña corriente que atrae a los palillos. El detergente, por otro lado, rompe la tensión superficial del agua e inmediatamente se extiende sobre la superficie. Mientras que se mueve por la superficie, también crea una corriente que lleva los palillos con ella.
5f
- Materiales
- Huevo (no codido)
- Un litro de agua
- 120 ml de sal
- 2 cuencos
- Métodos
- Agregue la sal y medio litro de agua a un cuenco y mezcle hasta que se desuelve la sal.
- Agregue el otro medio litro de agua en el otro cuenco pero no le ponga la sal todavía.
- Ponga el huevo en el agua con sal. Debe flotar.
- Mueva el huevo al agua sin sal. Debe hundirse.
El agua salada es más densa que el agua dulce, que significa que un volumen de agua salada pesa más que un volumen igual de agua dulce. La densidad de un huevo está entre la densidad del agua salada y agua dulce. Un elemento flotará si es menos denso que el líquido en el que se coloca. El huevo es más densa que el agua dulce y por eso se hunde. Pero, debido a que el huevo es menos denso que el agua salada, flota. NOTA: Si no pasa nada, obtenga dos huevos y coloque uno en el agua dulce y el otro en el agua salada. El huevo de agua dulce debe expandirse y el huevo de agua salada debe contraerse debido a la ósmosis.
5g
- Materiales
- Lana de acero
- Lápiz
- Gomita (bandita elástica)
- Vaso de vidrio
- Cuenco
- Agua
- Método
Utilice la gomita para sujetar la lana de acero al borrador del lápiz. El lápiz debe ser lo suficientemente corto para que puede caber dentro del vaso sin que sobresalga de la parte superior. Llenar hasta la mitad el vaso con agua y coloque el lápiz en el vaso con el montón de lana de acero en la parte inferior. Coloque un cuenco boca abajo sobre la parte superior del vaso y gire con cuidado el vaso y el cuenco de manera que el vaso está boca abajo y el cuenco está boca arriba. Añade un poco de agua al cuenco y marque el nivel de agua en el lado del vaso. Coloque el aparato en algún lugar donde no se verá interrumpido. Después de unos días, revise la lana de acero - debe estar oxidada.
Mientras la lana de acero se oxida, utiliza el oxígeno atrapado en el vaso. Esto reduce el volumen de aire adentro del vaso y la presión atmosférica fuera del vaso compensará por medio de empujar hacia abajo contra el agua dentro del cuenco. Esto entonces impulsará el agua dentro del vaso más alto. Compare el nivel actual del agua al nivel marcado en el comienzo del experimento.
5h
- Sal: La sal común de mesa es Cloruro de sodio y es un amarillo anaranjado
- Sulfato de cobre: Verde azul
- Ácido bórico: Verde brillante
Más colores/llamas (porque son muy coloridos)
5i
- Materiales
- Agua
- Vinagre, jugo de limón, azúcar, cebolla
- Vasos pequeños
- Vela o llama de estufa
- Papel
- Métodos
Puede mezclar el vinagre, jugo de limón, azúcar o jugo de cebolla con agua para crear una tinta invisible. Para hacer visible la tinta, manténgala con cuidado sobre una fuente de calor. La «tinta» se mostrará y llegará a ser visible. Trate de mezclar una pequeña cantidad de tinta que utiliza cada clase de ingrediente para ver cuál funciona mejor.
5j
- Materiales
- Tubos de ensayo/pinzas
- Soda de lavado/sosa/detergente
- Vela o llama de estufa
- Métodos
Ponga una pequeña cantidad de la sosa en el tubo de ensayo. Sostenga el tubo de ensayo con las pinzas sobre la llama. Verá un efecto como tornado en el interior del tubo de ensayo ya que el agua hace su «escape». ¡Es muy divertido para que todos vean!
Nota histórica
Esta especialidad fue clasificada previamente como una especialidad de Naturaleza con un fondo blanco.